[SdM]- Distanza di equilibrio tra nuclei.
Ciao a tutti, avrei da chiedervi un chiarimento riguardo un esercizio risolto che ho tra le mani.
ES.
La figura rappresenta lo spettro di assorbimento infrarosso di HBr gassoso. A partire dai dati sperimentali, determinare la distanza di equilibrio tra i nuclei di H e Br.

Svolgimento:
Siamo in approssimazione adiabatica vale. $E_(vib)$ può essere stimata dal grafico in modo approssimativo nel modo seguente:
Tra le energie di $0.31 eV$ e $0.32 eV$ sono presenti 4 picchi più il mancante relativo all'en. puramente vibrazionale, pertanto è possibile considerare circa 5 step. Pertanto:
$ DeltaE_(vib)=(0.32-0.31)/5=2*10^(-3) eV $ ogni step
nell'intervallo in esame, Il picco puramente vibrazionale si trova al quarto posto e pertanto si considerano 3 step:
$E_(vib)=0.31+3*2*10^(-3)=0.316 eV$
Fino a qui è tutto ok. Quello che non capisco è il passaggio successivo:
Si calcola la distanza di equilibrio tra i nuclei H e Br conscendo la distanza in energia tra due picchi rotazionali adiacenti e ricavando $I$ a partire dall'equazione:
$DeltaE_(rot)=(h-^2)/I=(2*10^(-3)+0.316)+(4*10^(-3)+0.316)$ con l'accortezza di passare da $eV$ a $J$
segue: $I=(h-^2)/(DeltaE_(rot))=3.4706*10^(-47) kg m^2$
$(h-^2)$ sarebbe l'acca tagliato al quadrato.
Domanda: ma per quale motivo $DeltaE_(rot)=(2*10^(-3)+0.316)+(4*10^(-3)+0.316)$? o più in generale: come faccio a dedurre dal grafico $DeltaE_(rot)$?
Grazie a chi mi aiuta!
.BRN
ES.
La figura rappresenta lo spettro di assorbimento infrarosso di HBr gassoso. A partire dai dati sperimentali, determinare la distanza di equilibrio tra i nuclei di H e Br.

Svolgimento:
Siamo in approssimazione adiabatica vale. $E_(vib)$ può essere stimata dal grafico in modo approssimativo nel modo seguente:
Tra le energie di $0.31 eV$ e $0.32 eV$ sono presenti 4 picchi più il mancante relativo all'en. puramente vibrazionale, pertanto è possibile considerare circa 5 step. Pertanto:
$ DeltaE_(vib)=(0.32-0.31)/5=2*10^(-3) eV $ ogni step
nell'intervallo in esame, Il picco puramente vibrazionale si trova al quarto posto e pertanto si considerano 3 step:
$E_(vib)=0.31+3*2*10^(-3)=0.316 eV$
Fino a qui è tutto ok. Quello che non capisco è il passaggio successivo:
Si calcola la distanza di equilibrio tra i nuclei H e Br conscendo la distanza in energia tra due picchi rotazionali adiacenti e ricavando $I$ a partire dall'equazione:
$DeltaE_(rot)=(h-^2)/I=(2*10^(-3)+0.316)+(4*10^(-3)+0.316)$ con l'accortezza di passare da $eV$ a $J$
segue: $I=(h-^2)/(DeltaE_(rot))=3.4706*10^(-47) kg m^2$
$(h-^2)$ sarebbe l'acca tagliato al quadrato.
Domanda: ma per quale motivo $DeltaE_(rot)=(2*10^(-3)+0.316)+(4*10^(-3)+0.316)$? o più in generale: come faccio a dedurre dal grafico $DeltaE_(rot)$?
Grazie a chi mi aiuta!
.BRN
Risposte
"BRN":
Svolgimento:
Siamo in approssimazione adiabatica vale. $E_(vib)$ può essere stimata dal grafico in modo approssimativo nel modo seguente:
Tra le energie di $0.31 eV$ e $0.32 eV$ sono presenti 4 picchi più il mancante relativo all'en. puramente vibrazionale, pertanto è possibile considerare circa 5 step. Pertanto:
$ DeltaE_(vib)=(0.32-0.31)/5=2*10^(-3) eV $ ogni step
nell'intervallo in esame, Il picco puramente vibrazionale si trova al quarto posto e pertanto si considerano 3 step:
$E_(vib)=0.31+3*2*10^(-3)=0.316 eV$
Fino a qui è tutto ok.
Ciao BRN
non mi sono chiari i tuoi passaggi. Qui tu stai facendo un po' di confusione tra stati vibrazionali e rotazionali, tra $E$ e $Delta E$.
Innanzitutto l'energia totale rotovibrazionale della tua molecola è data da:
$E = E_(vib) +E_(rot) = (v +1/2)h_t omega_0 +(h_t^2)/(2I)l(l+1)$
dove $h_t$ è h tagliato, $v$ ed $l$ e numeri quantici vibrazionali e rotazionali.
A questo punto si vede facilmente che tutti i livelli vibrazionali consecutivi sono spaziati in egual misura di $h_t omega_0$.
I salti energetici avvengono tra due livelli rotazionali appartenenti a due livelli vibrazionali differenti, quindi se consideriamo due livelli vibrazionali consecutivi si ha:
$Delta E = Delta E_(vib) +Delta E_(rot) = h_t omega_0 +(h_t^2)/(I)(l+1)$
Quindi la riga corrispondente ad $h_t omega_0$, che dovrebbe essere presente a $0,316 eV$, manca in quanto il salto rotazionale tra livelli con stesso numero quantico rotazionale ( $l_1=l_2 rArr Delta l=0$) è proibito.
Fino a qui tutto chiaro ?
"BRN":
Domanda: ma per quale motivo $ DeltaE_(rot)=(2*10^(-3)+0.316)+(4*10^(-3)+0.316) $? o più in generale: come faccio a dedurre dal grafico $ DeltaE_(rot) $?
Grazie a chi mi aiuta!
.BRN
Ora prova a correggere il tuo risultato.
Bye
Grazie Scotti per l'interessamento.
I passaggi che ho riportato non sono miei, ma quelli che trovo nella risoluzione data con l'esercizio.
Fino a qui sì, ma quello che non capisco è proprio questo passaggio:
$ DeltaE_(rot)=(h_t^2)/I=(2*10^(-3)+0.316)+(4*10^(-3)+0.316) $
Perchè $DeltaE_(rot)$ è uguale a quella roba???
I passaggi che ho riportato non sono miei, ma quelli che trovo nella risoluzione data con l'esercizio.
"Scotti":
Innanzitutto l'energia totale rotovibrazionale della tua molecola è data da:
$E = E_(vib) +E_(rot) = (v +1/2)h_t omega_0 +(h_t^2)/(2I)l(l+1)$
dove $h_t$ è h tagliato, $v$ ed $l$ e numeri quantici vibrazionali e rotazionali.
A questo punto si vede facilmente che tutti i livelli vibrazionali consecutivi sono spaziati in egual misura di $h_t omega_0$.
I salti energetici avvengono tra due livelli rotazionali appartenenti a due livelli vibrazionali differenti, quindi se consideriamo due livelli vibrazionali consecutivi si ha:
$Delta E = Delta E_(vib) +Delta E_(rot) = h_t omega_0 +(h_t^2)/(I)(l+1)$
Quindi la riga corrispondente ad $h_t omega_0$, che dovrebbe essere presente a $0,316 eV$, manca in quanto il salto rotazionale tra livelli con stesso numero quantico rotazionale ( $l_1=l_2 rArr Delta l=0$) è proibito.
Fino a qui tutto chiaro ?
e
Fino a qui sì, ma quello che non capisco è proprio questo passaggio:
$ DeltaE_(rot)=(h_t^2)/I=(2*10^(-3)+0.316)+(4*10^(-3)+0.316) $
Perchè $DeltaE_(rot)$ è uguale a quella roba???
Infatti quel passaggio è errato.
Devi considerare l'energia tra due picchi e quindi c'è un meno di mezzo, cioè:
$ DeltaE_(rot)=(h_t^2)/I=(4*10^(-3)+0.316)-(2*10^(-3)+0.316) =2*10^(-3) eV$
da cui ricavi $r_0$.
Devi considerare l'energia tra due picchi e quindi c'è un meno di mezzo, cioè:
$ DeltaE_(rot)=(h_t^2)/I=(4*10^(-3)+0.316)-(2*10^(-3)+0.316) =2*10^(-3) eV$
da cui ricavi $r_0$.
Ok, quindi c'è un evidente errore nella soluzione dell'esercizio.
Però non mi è ancora chiara una cosa: perchè la differenza tra due energie vibrazionali mi stimano la differenza di energia rotazionale?
Però non mi è ancora chiara una cosa: perchè la differenza tra due energie vibrazionali mi stimano la differenza di energia rotazionale?
"BRN":
perchè la differenza tra due energie vibrazionali mi stimano la differenza di energia rotazionale?
Questo è un problema di struttura della materia.
Chiariamo meglio.
In una molecola diatomica, per ogni stato elettronico eccitato e non, troviamo una gamma di stati energetici vibrazionali nucleari. Ognuno di questi si suddivide in una ulteriore gamma di stati energetici rotazionali.
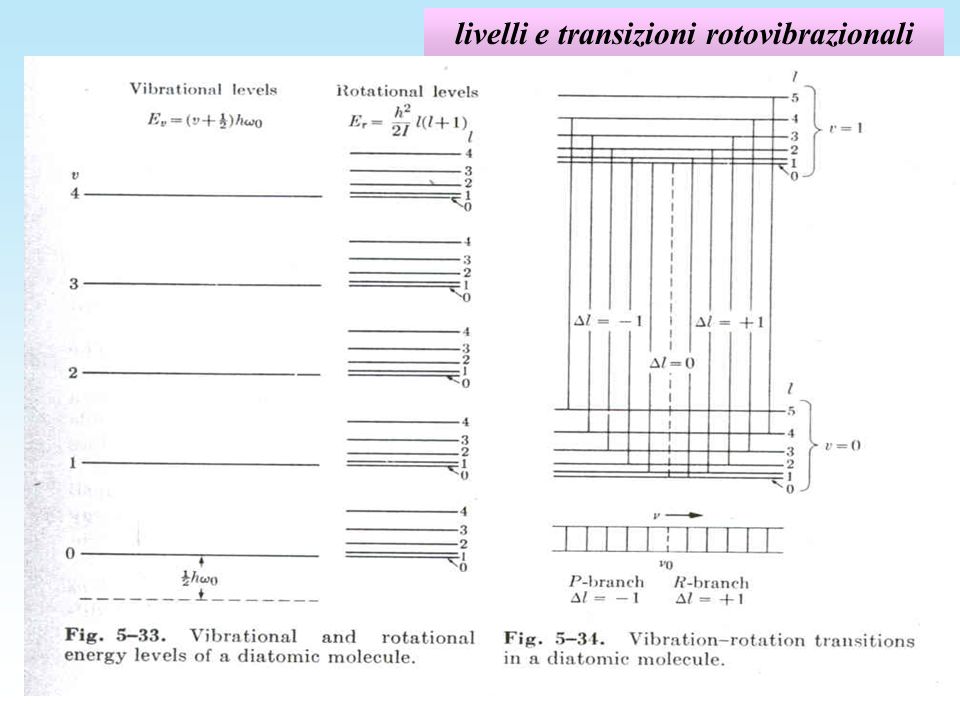
Le transizioni tra livelli energetici eccitati e non, avvengono secondo le regole di selezione quantistiche, ossia:
$Delta v =+-1$
$Delta l =+-1$
Ciò cosa significa: come vedi nella figura, ad ogni transizione vibrazionale (per es. tra $v=1$ a $v=0$) sarà associata una specifica transizione rotazionale (e quindi una specifica riga dello spettro: questo deve essere chiaro !!!)
$ Delta E = Delta E_(vib) +Delta E_(rot) = h_t omega_0 +(h_t^2)/(I)(l+1) $ (1)
Come vedi dalla (1) qualunque salto vibrazionale è distanziato di $h_t omega_0$ e quindi cadrà sempre nella stessa regione dello spettro indipendentemente dal valore di partenza di $v$, e questa energia nelle molecole diatomiche è tipicamente $approx 10^(-1) eV$ e cadono quindi nell'infrarosso.
Contemporaneamente la molecola si porterà su un livello energetico rotazionale diverso da quello di partenza secondo il
$Delta l =+-1$ e darà quindi un contributo energetico pari a
$Delta E_(rot) = (h_t^2)/(I)(l+1) $
che in questo caso invece dipende da $l$.
Quindi se ci fosse una transizione puramente vibrazionale avremmo una unica riga in $h_t omega_0$, ma con il contributo rotazionale le righe sono spaziate di
$ (h_t^2)/(I)$
Deve esserti chiaro che ogni riga dello spettro identifica un ben preciso salto energetico e non il valore assoluto dell'energia.
SSSSC
Bye
Quindi uno spettro roto-vibrazionale rappresenta le linee spettrali di un unico salto vibrazionale. Ogni picco rappresenta un salto rotazionale permesso e le energie sulle ascisse sono quelle del relativo salto rotazionale. Dove manca il picco c'è la transizione puramente vibrazionale e pertanto in quel punto dell'ascissa l'energia è quella vibrazionale.
Scusa, non mi uccidere se ancora non ho capito, ma la teoria la sto studiando sulle dispense del mio docente e sono un vero disastro...
Scusa, non mi uccidere se ancora non ho capito, ma la teoria la sto studiando sulle dispense del mio docente e sono un vero disastro...
"BRN":
Dove manca il picco c'è la transizione puramente vibrazionale e pertanto in quel punto dell'ascissa l'energia è quella vibrazionale.
Dove manca il picco non può esserci nessuna transizione ne rotazionale ne vibrazionale in quanto corrisponde ad un salto rotazionale proibito. Guarda il disegno postato.
Bye
Però dove manca il picco ho $DeltaE=h_tw_0=DeltaE_(vib)$ cioè il salto vibrazionale.
Altra cosa, tutte quelle transizioni rotazionali mostrate nello spettro avvengono in contemporanea giusto?
Altra cosa, tutte quelle transizioni rotazionali mostrate nello spettro avvengono in contemporanea giusto?
"BRN":
Però dove manca il picco ho $DeltaE=h_tw_0=DeltaE_(vib)$ cioè il salto vibrazionale.
Lo dici tu stesso: se manca il picco significa che non c'è emissione di fotone cioè di energia e quindi non c'è nessuna transizione.
Malgrado quel punto corrisponda al salto vibrazionale questo non avviene perché deve essere associato ad un salto rotazionale e quindi in questo caso l'energia emessa corrisponde proprio a quella delle righe spettrali.
Ripeto
Deve esserti chiaro che ogni riga dello spettro identifica un ben preciso salto energetico
Niente riga niente transizioni.
"BRN":
Altra cosa, tutte quelle transizioni rotazionali mostrate nello spettro avvengono in contemporanea giusto?
Le transizioni per un numero elevato di molecole avvengono in un tempo ragionevolmente piccolo e quindi praticamente in contemporanea.
Bye
Ok, ora mi è tutto chiaro.
Grazie mille Scotti, soprattutto per la pazienza
Ciao!
Grazie mille Scotti, soprattutto per la pazienza
Ciao!


 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo