Kimika:(:(
Quale atomo ha tendenza maggiore a formare ioni negativi???
A)Na
B)K
C)Ca
D)O
A)Na
B)K
C)Ca
D)O
Risposte
Gara, ma cosa c'entra la ionizzazione dell'acqua con il legame dativo??
E per le molecole polari/apolari... mmh, il fatto che l'acqua abbia una struttura inclinata non dipende dalla sua polarità, vabbè.... Bravo comunque ;)
E per le molecole polari/apolari... mmh, il fatto che l'acqua abbia una struttura inclinata non dipende dalla sua polarità, vabbè.... Bravo comunque ;)
Li ho sbagliati gli esercizi?Io li ho fatti basandomi sull elettronegativita cioe quando era diversa l'elettronegativita ho messo polare mentre quando era uguale ho messo apolare
Mi rispondete x favore??
Mi rispondete x favore??
Affinchè una molecola sia polare, il baricentro della carica negativa non deve coincidere con il baricentro della carica positiva!
Prova a farti il disegno degli atomi e dei legami fra di loro, e giungi alla formula di struttura. Da lì riesci a capire se è polare o apolare.
Comunque di quelle che hai fatto te, io al momento conosco a memoria solo la
Per farti capire la differenza, la molecola d'acqua è polare perchè tra gli atomi di idrogeno (entrambi caricati positivamente in modo parziale) ci sono delle forze di repulsione che tendono a farli aprire fino a 180°; ma l'ossigeno possiede altre due coppie di elettroni non impegnate nel legame che limitano questa espansione fino a raggiungere un angolo di 105°. Pertanto i baricentri non possono coincidere nello stesso punto!
Prova a farti il disegno degli atomi e dei legami fra di loro, e giungi alla formula di struttura. Da lì riesci a capire se è polare o apolare.
Comunque di quelle che hai fatto te, io al momento conosco a memoria solo la
[math]CO_2[/math]
, ovvero l'anidride carbonica. Se fai la formula di struttura ti accorgi che l'atomo di carbonio e legato ai due di idrogeno tramite legami covalenti doppi, ma questi sono disposti sullo stesso piano (orizzontale): ciò significa che il baricentro delle cariche opposte coincide nello stesso punto, ovvero nella posizione del carbonio! Perciò la molecola di anidride carbonica è apolare!Per farti capire la differenza, la molecola d'acqua è polare perchè tra gli atomi di idrogeno (entrambi caricati positivamente in modo parziale) ci sono delle forze di repulsione che tendono a farli aprire fino a 180°; ma l'ossigeno possiede altre due coppie di elettroni non impegnate nel legame che limitano questa espansione fino a raggiungere un angolo di 105°. Pertanto i baricentri non possono coincidere nello stesso punto!
Ma fra NaF,NO,PbS,CH4 quello piu elettronegativo è CH4?xke NaF ha elettronegativita 4,9 NO 6,5 PbS 4,3 e CH4 10,9....giusto???
E qst altro indika se le seguenti molekole presentano legami covalenti polari o apolari
a)HBr
b)CF4
c)F2
d)CO2
e)CL2
allora ho messo a apolare b polare c apolare d polare e è apolare
giustoo????mi dite solo se ho fatto bene o no??
rispondetemi x piacereee
E qst altro indika se le seguenti molekole presentano legami covalenti polari o apolari
a)HBr
b)CF4
c)F2
d)CO2
e)CL2
allora ho messo a apolare b polare c apolare d polare e è apolare
giustoo????mi dite solo se ho fatto bene o no??
rispondetemi x piacereee
Il legame covalente dativo, detto in modo molto semplice, consiste nella condivisione di una coppia di elettroni tra un atomo che può donarla e un atomo che, disponendo di un orbitale vuota, può accettarla.
Ti faccio l'esempio della ionizzazione dell'acqua.
La molecola d'acqua è formata da un atomo di ossigeno che si lega tramite legami covalenti semplici a due atomi di idrogeno. Essendo l'ossigeno maggiormente elettronegativo, i due atomi di idrogeno diventano entrambi caricati positivamente in modo parziale
Per effetto di alcune forze di repulsione che si attuano tra idrogeno ed ossigeno in rari casi, il legame covalente tra l'atomo di idrogeno e quello di ossigeno può rompersi. L'atomo di idrogeno si "libera" dal legame, ma perde l'elettrone che condivideva con l'ossigeno: diventa a tutti gli effetti uno ione positivo
L'atomo di idrogeno liberatosi dalla molecola d'acqua possiede così solo un protone: ha perso anche quell'unico elettrone di cui disponeva, perciò il suo orbitale è vuoto. E' molto instabile, quindi molto reattivo. Se incontra una molecola d'acqua, esso reagisce con l'ossigeno di questa molecola fino a formare lo ione positivo idronio: l'ossigeno, infatti, per formare la molecola d'acqua, impegna nei legami con l'idrogeno solo 4 dei suoi 8 elettroni del secondo livello. Quindi ha altre due coppie a disposizione per formare ulteriori legami. L'idrogeno, che non ha nessun elettrone, necessita al più presto di trovare un atomo che gli metta a disposizione una coppia già pronta di elettroni: per questo reagisce con l'ossigeno. Si forma un legame covalente dativo: la differenza sostanziale con un legame covalente "normale" è che in questo caso ogni atomo mette a disposizione qualche elettrone, mentre nel legame covalente dativo gli elettroni sono messi in condivisione da un atomo già stabile e completo per (diciamo così) fare un favore ad un atomo che non ne ha nemmeno uno e che quindi è molto instabile e incompleto.
Ricapitolando la ionizzazione dell'acqua è questa:
Ti faccio l'esempio della ionizzazione dell'acqua.
La molecola d'acqua è formata da un atomo di ossigeno che si lega tramite legami covalenti semplici a due atomi di idrogeno. Essendo l'ossigeno maggiormente elettronegativo, i due atomi di idrogeno diventano entrambi caricati positivamente in modo parziale
[math] \left ( H^{\delta +} \right ) [/math]
, mentre l'ossigeno, che attrae a sè in maniere maggiore le due coppie impegnate nei legami, assume due cariche negative parziali [math] \left ( O^{\delta 2-} \right ) [/math]
.Per effetto di alcune forze di repulsione che si attuano tra idrogeno ed ossigeno in rari casi, il legame covalente tra l'atomo di idrogeno e quello di ossigeno può rompersi. L'atomo di idrogeno si "libera" dal legame, ma perde l'elettrone che condivideva con l'ossigeno: diventa a tutti gli effetti uno ione positivo
[math] \left ( H^{+} \right ) [/math]
. Della molecola d'acqua di partenza, rimane quindi lo ione negativo [math] \left ( OH^{-} \right ) [/math]
, ovvero lo ione ossidrile. [math]H_2 O \longrightarrow H^{+} + OH^{-} [/math]
L'atomo di idrogeno liberatosi dalla molecola d'acqua possiede così solo un protone: ha perso anche quell'unico elettrone di cui disponeva, perciò il suo orbitale è vuoto. E' molto instabile, quindi molto reattivo. Se incontra una molecola d'acqua, esso reagisce con l'ossigeno di questa molecola fino a formare lo ione positivo idronio: l'ossigeno, infatti, per formare la molecola d'acqua, impegna nei legami con l'idrogeno solo 4 dei suoi 8 elettroni del secondo livello. Quindi ha altre due coppie a disposizione per formare ulteriori legami. L'idrogeno, che non ha nessun elettrone, necessita al più presto di trovare un atomo che gli metta a disposizione una coppia già pronta di elettroni: per questo reagisce con l'ossigeno. Si forma un legame covalente dativo: la differenza sostanziale con un legame covalente "normale" è che in questo caso ogni atomo mette a disposizione qualche elettrone, mentre nel legame covalente dativo gli elettroni sono messi in condivisione da un atomo già stabile e completo per (diciamo così) fare un favore ad un atomo che non ne ha nemmeno uno e che quindi è molto instabile e incompleto.
[math]H_2 O + H^{+} \longrightarrow H_3 O^{+} [/math]
Ricapitolando la ionizzazione dell'acqua è questa:
[math]2 H_2 O \longrightarrow H_3 O^{+} + OH^{-} [/math]
Allora il legame dativo funziona più o meno uguale. E' della stessa natura del legame covalente, cioè è una particolarità del legame covalente. Funziona insomma che una coppia di elettroni già appaiati, cioè già insieme che si trova su un orbitale s, si spaia, cioè la coppia si distrugge e questi due elettroni si vannoa a legare ad altri elettroni di altri atomi per esempio.....
http://img207.imageshack.us/my.php?image=immagineic7.png
http://img207.imageshack.us/my.php?image=immagineic7.png
IN QUESTO CASO, N CHE HA 5 ELETTRONI SULL'ULTIMO LIVELLE ENERGETICO LI METTE A DISPOSIZIONE TT E 5. i TRE SULL ORBITALE P LI LEGA CON LEGAMI COVALENTI NORMALI, MENTRE GLI ALTRI 2 CHE SI TROVANO SULL'ORBITALE S LI LEGA CON LEGAME DATIVO.QUESTI SI SPAIANO, CIOè DISTRUGGONO LA COPPIA E SI VANNO A LEGARE CON ALTRI ELETTRONI.
Ho kapito glia:):) mentre il legame covalente dativo??
Va be grazie cmq lo letto io lo kapito:):) il dativo grazie ora faccio gli esercizi ti faccio sapere se c'è qlk problema
Va be grazie cmq lo letto io lo kapito:):) il dativo grazie ora faccio gli esercizi ti faccio sapere se c'è qlk problema
Si, N2 è un esempio di legame covalente triplo.Si piccolastella!!
Si xo x il legame N e N ne devo condividere 3...!!!!No??
Nell'esempio ke mi hai fatto prima x qst quindi diventa H2 O?Xke l'idrogeno ha solo un elettrone xo ad N ne serve un altro x raggiungere la stabilita??giusto??
Nell'esempio ke mi hai fatto prima x qst quindi diventa H2 O?Xke l'idrogeno ha solo un elettrone xo ad N ne serve un altro x raggiungere la stabilita??giusto??
Si, però conta sempre l'eccezioni, per esempio, N, azoto ha più valenze 2,3,5!!
quindi x gli elementi del I II III IV ne mettono a disposizione 1-2-3-4 mentre V VI VII VIII 3-2-1-0 giusto?
Allora, vediamo se ti posso spiegare semplicemente. Se io ho un atomo di H, che ha solo un elettrone sull'ultimo livello energetico, questo si deve necessariamente legare con un altro atomo per raggiungere la stabilità. Ora se si legasse mettiamo con l'ossigeno, che ne ha sue di elettroni sull'ultimo livello energetico, non ce ne basta solo uno di atomo di H, ma ce ne vogliono due, perchè l'H di per sè mette a disposizione solo un elettrone (ha solo quello) mentre all'O gliene servono due. In questo caso (e questo è il caso dell'acqua) si forma una molecola che ha 2 atomi di H e uno di 0.Se ce ne fosse solo 1 di H, anzichè 2, si formerebbe HO, che non esiste. Perciò quando devi stabilire che tipo di legami covalente si forma, se semplice, doppio o triplo devi stabilire la valenza, ovvero quanti elettroni mette a disposizione l'atomo nel legame.
Nel caso dell'acqua abbiamo una composizione chimica così:
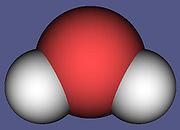
Cioè:

Quindi possiamo dire che per stabilire che tipo di lagami si forma bisogna tenere conto di quanti elettroni mettono a disposizione gli atomi che si legame (VALENZA)
Nel caso dell'acqua abbiamo una composizione chimica così:

Cioè:

LEGAMI COVALENTI SEMPLICI,POICHè L'H METTE A DISPOSIZIONE SOLO UN ELETTRONE
Quindi possiamo dire che per stabilire che tipo di lagami si forma bisogna tenere conto di quanti elettroni mettono a disposizione gli atomi che si legame (VALENZA)
Allora x formare un legame covalente normale...nn ho kapito bene come faccio a sapere quanti elettroni devo mettere in comune
Se io x fare il legame kimiko devo mettere in komune gli elettroni ke mi servono x completare l'ottetto xke nell idrogeno ne mettono solo 1?
Se io x fare il legame kimiko devo mettere in komune gli elettroni ke mi servono x completare l'ottetto xke nell idrogeno ne mettono solo 1?
Aspetta, non ho capito bene... spiegati meglio
Ma nel legame covalente io devo mettere in komune gli elementi ke restano x kompletare l'ottetto tipo in P ne devo mettere in comune 3 atomi quindi 2koppier giusto??Ma nel legame dativo se io ho NH3 ad esempio cm faccio??
In base a quanti elettroni di valenza mettono a disposizione gli atomi nel legame!
io cm faccio a sapere se è un legame covalente a due coppie o piu coppie???
1) numero di elettroni di valenza= 8 xk gli elettroni di valenza sono 8 perchè il neon fa parte dell'ottavo gruppo
la configurazione elettronica è quella delle freccette
2)CA perde due elettroni e ha la stessa configurazione elettronica esterna del gas nobile che lo precede nella tavola periodica argo
CA2+
S zolfo, acquista due elettroni quindi ha la stessa configurazione elettronica esterna del gas che lo segue nella tavola periodica, Argo
S2-
He non perde elettroni, è un gas nobile
F flouro, perde un elettrone quindi ha la stessa configurazione elettronica esterna del gas che lo segue nella tavola periodica, Argo
F-
VAbbè c'è sempre l'ARgo, quindi fai la configurazione elettronica con le freccette
la configurazione elettronica è quella delle freccette
2)CA perde due elettroni e ha la stessa configurazione elettronica esterna del gas nobile che lo precede nella tavola periodica argo
CA2+
S zolfo, acquista due elettroni quindi ha la stessa configurazione elettronica esterna del gas che lo segue nella tavola periodica, Argo
S2-
He non perde elettroni, è un gas nobile
F flouro, perde un elettrone quindi ha la stessa configurazione elettronica esterna del gas che lo segue nella tavola periodica, Argo
F-
VAbbè c'è sempre l'ARgo, quindi fai la configurazione elettronica con le freccette
aa okkk:)
qst altri 2 esercizi
Scrivi la configurazione elettronica del neon individuando il livello piu esterno e il numero di elettroni di valenza
poi
Quanti elettroni vengono persi o acquistati dai seguenti atomi per completare l'ottetto?Scrivi la configurazione del gas nobile ke ne risulta
A)Ca
B)S
C)He
D)F
Grazie di tt!!!!!
qst altri 2 esercizi
Scrivi la configurazione elettronica del neon individuando il livello piu esterno e il numero di elettroni di valenza
poi
Quanti elettroni vengono persi o acquistati dai seguenti atomi per completare l'ottetto?Scrivi la configurazione del gas nobile ke ne risulta
A)Ca
B)S
C)He
D)F
Grazie di tt!!!!!
L'affinità elettronica è la quantità di energia che si manifesta quando un elettrone di un atomo si combia con gli elettroni di un atomo isolato
I gas nobili sono inerti, non si combina, sono già stabili. Quindi la loro affinità è=0
I gas nobili sono inerti, non si combina, sono già stabili. Quindi la loro affinità è=0






 Accedi a tutti gli appunti
Accedi a tutti gli appunti
 Tutor AI: studia meglio e in meno tempo
Tutor AI: studia meglio e in meno tempo